![[식품의약품안전처] 임상시험자료 공동이용 의약품 허가 신청 변경사항 안내 [식품의약품안전처] 임상시험자료 공동이용 의약품 허가 신청 변경사항 안내](https://mblogthumb-phinf.pstatic.net/MjAyMTA4MjdfMTE5/MDAxNjMwMDI0MDAzOTY5.MKlocu0mkxLD4SxUgW06KNbHu8llp0jYnguzmDE1Z1cg.Qx_3iBL8wjSEn-A9u9rvSXbc_Y-1DAfipzRevOtDysgg.PNG.ash1106/image.png?type=w2)
임상시험자료 공동이용 의약품 허가 신청 변경사항 안내 2021.08.27 식품의약품안전처 식품의약품안전처(처장 김강립)는 동일한 임상시험 자료를 활용해 추가로 허가받을 수 있는 의약품 품목 수를 3개까지로 제한하는 제도가 「약사법」 개정(’21.7.20.)으로 시행됨에 따라, 의약품 품목허가·신고 신청 시 작성해야 하는 항목*과 입력 요령을 안내합니다. * 의약품안전나라 누리집(nedrug.mfds.go.kr)에서 8월 27일부터 입력 가능 의약품 품목허가‧신고 신청 시 신규로 입력해야 하는 항목은 임상시험 자료 공동이용 또는 공동개발신고 입니다. ① 임상시험 자료 공동이용 항목은 임상시험 자료를 공동으로 이용한 품목의 경우 작성..........
[식품의약품안전처] 임상시험자료 공동이용 의약품 허가 신청 변경사항 안내에 대한 요약내용입니다.
자세한 내용은 아래에 원문링크를 확인해주시기 바랍니다.
원문링크 : [식품의약품안전처] 임상시험자료 공동이용 의약품 허가 신청 변경사항 안내
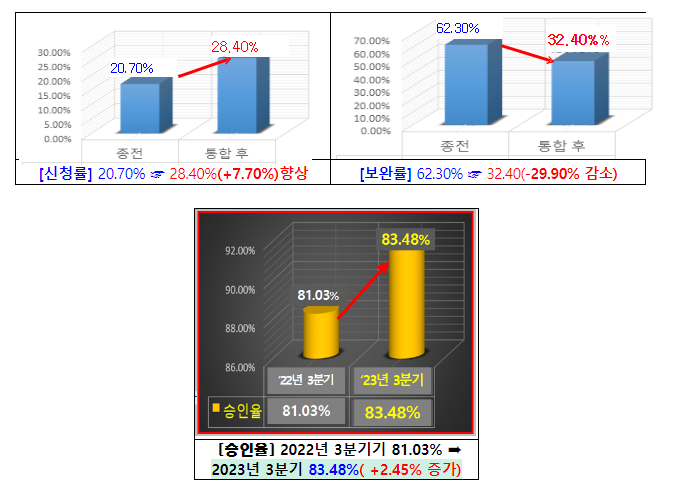
![[오늘오후뉴스] 소복히 쌓여가는 물건…경매도 '한파주의보' 등](https://mblogthumb-phinf.pstatic.net/MjAyMjEyMDZfOTcg/MDAxNjcwMzAzMjg0NDIw.xn_YnNF19H_GIR70y1SBF8VbTLY7ZFCJ7yoHlIKNtSsg.M1SFDYbGfd6eEUZBOhvsD93olU2FtrFX3FLR1uiZZugg.PNG.ash1106/image.png?type=w2)
![[식품의약품안전처] ‘실시간상거래 방송’, 식품 등 부당광고 관리 강화(라이브커머스 방송, 플랫폼업체 117개 방송 집중 점검… 부당광고 21건(17.9%) 적발‧조치)](https://mblogthumb-phinf.pstatic.net/MjAyMTA3MjJfMjg4/MDAxNjI2OTE3MzYzNTU4.FZud1VHGioHboj12GlAY6ypyP6AEo2kfulhaAdX0XJgg.HB2Z3W91Y1XYoTom0Qefn5mlmv8SDFE5DfBMQm7rq_sg.PNG.ash1106/image.png?type=w2)

![[행정안전부] 호우 피해주민의 생계 안정을 위한 국비 긴급 지원](https://blogimgs.pstatic.net/nblog/mylog/post/og_default_image_160610.png)
![[경기] 수원시 2023년 창업ㆍ중소기업 arirangTV 송출 영상제작 지원 사업 참가희망 창업ㆍ중소제조기업 모집 공고](https://mblogthumb-phinf.pstatic.net/MjAyMzAzMTdfMTQw/MDAxNjc5MDY0MDAyMjky.RJnH5xCtG-bFjLXIvivZGNA31I7alDCffbfHDfTbBmUg.dFQcbnPKYt7q6c7TssjlGfQqhCWe41JOzk82iJo-BaQg.PNG.ash1106/image.png?type=w2)
 네이버 블로그
네이버 블로그 티스토리
티스토리 커뮤니티
커뮤니티