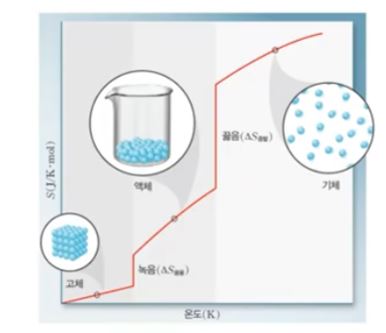
【 목 차 】 1. 자발적 과정 2. 엔트로피 3. 계의 엔트로피 변화 4. 주위의 엔트로피 변화 5. 반응의 자발성 예측 : 자유 에너지 1. 자발적 과정 가. 자발적 과정 (Spontaneous Process) 외부의 영향없이 스스로 진행하는 과정 ⊙ 기체의 진공 팽창은 자발적 과정 ⊙ 위 그림에서 코크(Cock)를 열기만 했는데 기체가 알아서 확산한다. 이렇게 펴져서 양쪽에 기체가 존재하는데 이 때 한쪽으로만 쏠리는 현상은 절대 일어나지 않는다. 따라서 정반응은 자발적이지만 기체가 진공상태로 팽창하는 것은 자발적 과정이지만 역반응은 일어나지 않는 비자발적 과정이다. ⊙ 백금 촉매 존재하에 수소와 산소의 결합반응 정반응은 자발적 과정이나 역반응은 비자발적 과정이다. 수소와 산소가 만나 물이..
원문링크 : 엔트로피와 자유에너지 - 기초 화학



 네이버 블로그
네이버 블로그 티스토리
티스토리 커뮤니티
커뮤니티