
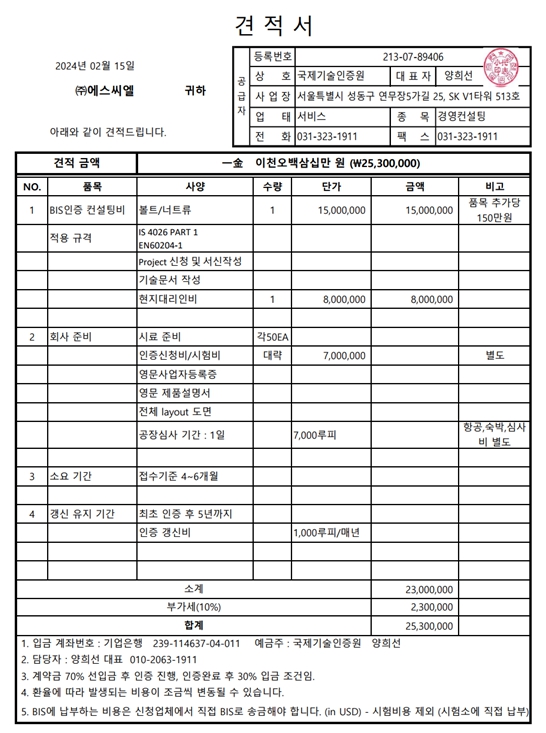
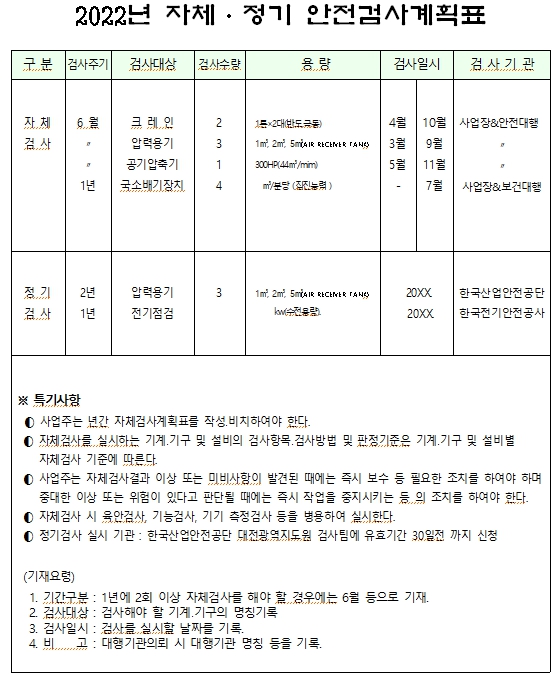
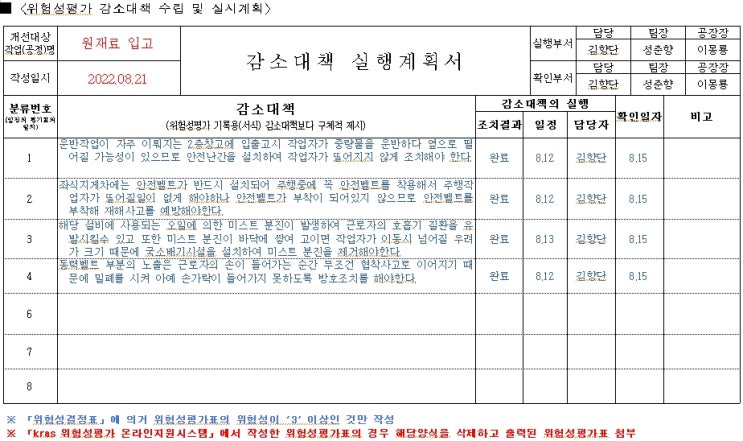
제조·수입 및 품질관리기준 적합성평가 세부절차 적합성평가 신청 임상시험용 의료기기의 제조·수입자는 임상시험실시전에, 의료기기제조·수입업자는 의료기기 제조·수입업의 허가 후 제품의 판매전에 품질관리기준의 적합성평가를 받아야 함 동일 품목군에 속하는 제품이라 하더라도 1등급에 2·3·4 등급을 추가하거나, 다른 품목군의 의료기기를 추가한 경우 새로이 적합성평가를 받아야 함 ※ 1등급 의료기기(멸균의료기기는 제외한다)의 경우 별표1「의료기기제조및품질관리기준 적합성평가 기준 및 평가표」에 있어 4.1, 4.2, 5.5, 6.4, 7.1, 7.4, 7.5, 7.6, 8.2.1, 8.2.2, 8.2.3, 8.2.6, 8.3, 8.5의 사항만 적용 실시 현장심사대상(신규 제조소,정기갱신심사,제조소의 변경 또는 추가 시,신개발 의료기기, 최근 3년간 품질 부적합 안유문제 발생 시,서류 미제출 해외 제조소) ※ 대표자변경,등급상향,멸균추가는 심사대상이 아님 구비서류 의료기기 품질관리기준 적합인정 신...
#GMP
#제조업허가
#의료기기제조
#의료기기인증
#식약처인증
#수입업허가
#밸리데이션
#KGMP
#ISO13485
#품목허가
원문링크 : 의료기기GMP 심사 절차도와 인증대행





 네이버 블로그
네이버 블로그 티스토리
티스토리 커뮤니티
커뮤니티