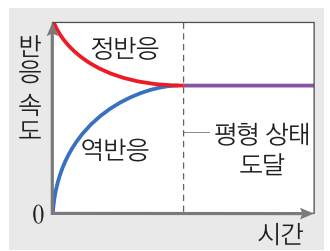
1. 화학 평형과 평형 상수 화학 평형 : 정반응과 역반응 모두 일어날 수 있는 반응을 가역 반응이라 하는데, 가역 반응에서 모든 반응물과 생성물의 농도가 시간에 따라 변하지 않고 일정하게 유지되는 상태를 화학 평형 상태라 한다. 이 상태에서는 겉보기에는 변화가 없어 반응이 정지된 것처럼 보이지만 실제로는 정반응과 역반응이 같은 속도로 끊임없이 일어나고 있는 동적 평형 상태이다. 평형 상수 K : 일정한 온도에서 화학 평형 상태일 때, 반응물의 농도 곱에 대한 생성물의 농도 곱의 비는 항상 일정한데, 이를 화학 평형 법칙이라 하고, 평형 상수 K를 이용하여 1보다 매우 크면 정반응이 우세하여 평형 상태에서 생성물이 더 많이 존재함을, 1보다 매우 작으면 역반응이 우세하여 평형 상태에서 반응물이 더 많이 존재함을 알아낼 수가 있다. 반응 지수 Q : 반응물과 생성물을 함께 넣었을 때의 반응의 진행 방향을 알아내기 위해 반응 지수 Q를 도입하였는데, 평형 상수 K 구하는 방식을 이용하되...
원문링크 : 화학 2 - 화학 평형




 네이버 블로그
네이버 블로그 티스토리
티스토리 커뮤니티
커뮤니티