
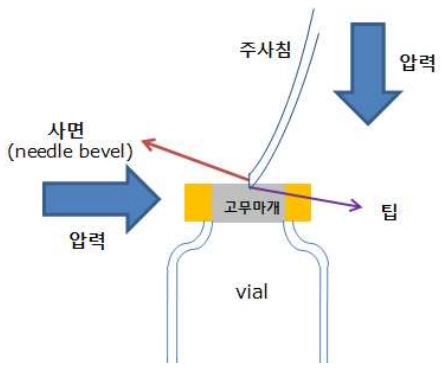
타액 검체로 코로나19 검사 가능한 시약, 개정된 유럽 인증 획득 목표 권혁진 기자 [email protected] 입력 2022.07.20 15:14 수정 2022.07.20 15:14 바이오니아는 최근 범부처전주기 의료기기 연구개발사업단 주관 ‘유럽체외진단 의료기기 인증을 위한 코로나19 체외진단시약의 유효성 평가’ 과제에 선정됐다고 지난 19일 밝혔다. 이번 과제는 총 25억원 규모로, 코로나19 진단 시약의 유럽 임상시험을 통해 개정된 유럽 인증 심사(CE-IVDR)를 획득을 목표로 한다. 바이오니아의 코로나19 체외진단 시약은 타액 검체를 사용한다. 바이오니아에 따르면 비인두, 구인두 도말 검체 체취 보다 타액 검체를 사용할 때 크게 세 가지의 장점이 있다. 첫번째는 사용의 편리성과 안전성이다. 면봉을 코나 목구멍 속으로 깊숙이 밀어 넣어 검체를 채취하는 기존 검사법은 채취과정에서 불편함을 느끼는 환자가 많았다. 재채기나 기침을 유발해 바이러스가 퍼져 나가기 쉬운 환경을 만들...
#바이오니아
#의료기기
#진단시약
#체외진단
#코로나19
원문링크 : 바이오니아 ‘코로나19 진단시약 유효성 평가’ 정부 과제 선정


 네이버 블로그
네이버 블로그 티스토리
티스토리 커뮤니티
커뮤니티